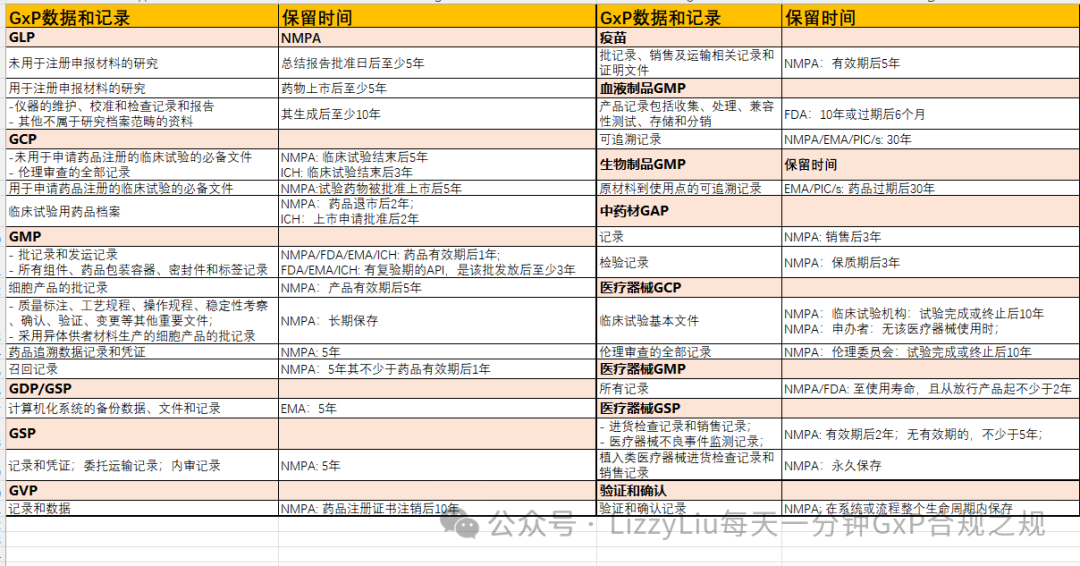
各国GMP法规【不同记录的保留期限】
注:这里的记录指的是原始记录或真实副本,其中包括相关的元数据和支持数据。
GCP要求保留归档的内容:来源于NMPA 2016年发布的临床试验数据管理工作技术指南
归档内容 | 要求 |
临床试验数据 | 试验中收集的所有数据。这些数据既包括记录在病例报告表上的数据也包括非病例报告表收集的数据(例如实验室检查结果,心电图检查结果以及受试者电子日记)。 |
外部数据 | 外部收集并将导入至临床试验数据管理系统(CDMS)的数据,包括所有导入的数据及其文件和用于外部数据质量控制的所有文件。 |
数据库元数据信息 | 临床试验数据结构相关信息。这类典型信息是表、变量名、表单、访视和任何其他相关对象,也包括编码列表。 |
数据管理计划书 | 数据管理计划的微软Word或PowerPoint文档可以转成PDF格式文件或打印成纸张文件归档保存。 |
编码词典 | 如果数据是使用公司内词典或同义词表自动编码,那么使用的词典和统一词表都应归档保存。 |
实验室检查参考值范围 | 实验室检查的参考值范围。如果临床试验研究过程中使用多个版本的参考值范围,那么每个版本的参考值范围都应归档保存。 |
稽查轨迹 | 试验稽查轨迹的整个内容,并使用防修改的方式。 |
逻辑检验,衍生数据变更控制列表 | 以工作清单、工作文件、工作报告的形式提供逻辑检验定义和衍生数据的算法,以及它们的变更控制记录。 |
数据质疑表 | 所有数据质疑表,传递数据质疑表的相关邮件及数据质疑表解答的复印件。纸张形式的数据质疑表可以扫描归档保存,并且为扫描文件添加索引。 |
程序代码 | 数据质量核查程序的代码,衍生数据的代码以及临床试验数据统计分析的程序代码。程序代码文档应归档保存。最理想情况是,这些文件以在线方式保存,并编制索引或超链接。 |
病例报告表的映像PDF 格式文件 | 对于纸张的病例报告表临床试验来说,CRF映像文件通常可以通过扫描方式获得,并将这些扫描文件转成PDF格式。对于电子数据采集的临床试验来说,电子表单的PDF格式映像文件可以通过EDC/M应用创建。 |
其他 | 其他与数据管理相关的文件,如数据库锁库和开锁记录、数据库使用者清单等。 |
疫苗要求保留归档的内容:来源于NMPA 2019年发布的疫苗管理法
归档内容 | 要求 |
证明文件 | 疾病预防控制机构、接种单位保留: - 加盖其印章的批签发证明复印件或者电子文件 - 加盖其印章的进口药品通关单复印件或者电子文件 |
| 销售记录 | 疫苗上市许可持有人应当按照规定,建立真实、准确、完整的销售记录 |
| 接收、购进、储存、配送、供应记录 | 疾病预防控制机构、接种单位、疫苗配送单位应当按照规定,建立真实、准确、完整的接收、购进、储存、配送、供应记录 |
| 温度监测记录 | 疾病预防控制机构、接种单位接收或者购进疫苗时,应当索取本次运输、储存全过程温度监测记录 |
| 处置记录 | 疾病预防控制机构、接种单位应当如实记录处置情况 |
| 接种记录 | 医疗卫生人员应当真实、准确、完整记录疫苗的品种、上市许可持有人、最小包装单位的识别信息、有效期、接种时间、实施接种的医疗卫生人员、受种者等接种信息,确保接种信息可追溯、可查询。 |
保存期限长(如大于5年)的以纸质形式存在的文件,可以采用扫描等方式对 其做电子化处理后予以保存,这种情况下,可酌情缩短纸质版文件的保存期限(推荐不低于5年,且批记录的纸质版本仍需满足基于产品有效期/复验期的保存期限要求)。需要注意的是:在整个纸质文件保存期内,纸质文件应视为主数据,其转化所得的电子文件应经确认为原始纸质文件的真实副本。企业应建立相关规程,明确这种转化操作的适用范围和前提,明确转化流程及复核要求、主数据的认定原则,并记录转化操作及检查确认结果。
以纸质形式保存文件时,其保存区域(档案室)应有必要的防火、防蛀、防潮、防霉及安全性保护措施,配备必要的环境湿度调控设施以维持较低的环境湿度。
以电子形式保存的文件,要定期检查其完整性、可读性,并做好备份管理,通过异地备份等方式减少突发灾难下的损失。